Ph9 Atome: Unterschied zwischen den Versionen
| Zeile 29: | Zeile 29: | ||
| − | {{Merksatz|MERK=Atomkerne bestehen aus | + | {{Merksatz|MERK=Atomkerne bestehen aus positiv geladenen Protonen und ungeladenen Neutronen. Protonen und Neutronen sind die '''Kernbausteine''' oder '''Nukleonen'''. Protonen und Neutronen haben ungefähr die gleiche Masse und gleichen Durchmesser.<br> |
<math>m_{Proton} = 1,6727\cdot 10^{-27}kg, r_{Proton}\approx 1\cdot 10^{-15}m, m_{Neutron}=1,6750\cdot 10^{-27}kg, r_{Neutron}\approx 1\cdot 10^{-15}m</math><br> | <math>m_{Proton} = 1,6727\cdot 10^{-27}kg, r_{Proton}\approx 1\cdot 10^{-15}m, m_{Neutron}=1,6750\cdot 10^{-27}kg, r_{Neutron}\approx 1\cdot 10^{-15}m</math><br> | ||
Im Atomkern gibt es genauso viele Protonen wie Elektronen in der Atomhülle. Das Atomo ist nach außen hin elektrisch neutral. <br> | Im Atomkern gibt es genauso viele Protonen wie Elektronen in der Atomhülle. Das Atomo ist nach außen hin elektrisch neutral. <br> | ||
| Zeile 37: | Zeile 37: | ||
Da die Masse der Elektronen in der Atomhülle sehr sehr klein ist, die Masse eines Elektrons ist <math>9,1\cdot 10^{-31}kg</math>, bestimmen im Wesentlichen die Nukleonen die Atommasse. Daher ist die Massenzahl für ein Atom gleich der Nukleonenzahl A. Man verwendet auch A als Bezeichnung für die Massenzahl. | Da die Masse der Elektronen in der Atomhülle sehr sehr klein ist, die Masse eines Elektrons ist <math>9,1\cdot 10^{-31}kg</math>, bestimmen im Wesentlichen die Nukleonen die Atommasse. Daher ist die Massenzahl für ein Atom gleich der Nukleonenzahl A. Man verwendet auch A als Bezeichnung für die Massenzahl. | ||
| − | Bei der Schreibweise <math>^A_Z | + | Bei der Schreibweise <math>^A_Z Elementbezeichnung</math> sind<br> |
A = Anzahl der Kernbausteine (Nukleonen) im Atomkern.<br> | A = Anzahl der Kernbausteine (Nukleonen) im Atomkern.<br> | ||
Z = Anzahl der Protonen im Atomkern, Ordnungszahl, Anzahl der Elektronen in der Hülle<br> | Z = Anzahl der Protonen im Atomkern, Ordnungszahl, Anzahl der Elektronen in der Hülle<br> | ||
| Zeile 71: | Zeile 71: | ||
'''Ausblick:''' Experimente mit Protonen, Neutronen und Elektronen werden in großen Forschungsanlagen gemacht. In solchen Anlagen werden die Teilchen auf sehr große Geschwindigkeiten (Elektronen haben fast Lichtgeschwindigkeit) gebracht und sie treffen dann aufeinander. <br> | '''Ausblick:''' Experimente mit Protonen, Neutronen und Elektronen werden in großen Forschungsanlagen gemacht. In solchen Anlagen werden die Teilchen auf sehr große Geschwindigkeiten (Elektronen haben fast Lichtgeschwindigkeit) gebracht und sie treffen dann aufeinander. <br> | ||
| − | Eine Anlage in USA ist | + | Eine Anlage in USA ist [https://de.wikipedia.org/wiki/Stanford_Linear_Accelerator_Center SLAC] und in Europa [https://de.wikipedia.org/wiki/CERN CERN] |
Aktuelle Version vom 5. Mai 2021, 07:28 Uhr
Es handelt sich um ein Silberatom.
In der Atomhülle sind 47 Elektronen, also sind 47 negative Elementarladungen in der Atomhülle.
Da das Atom insgesamt neutral ist, hat der Atomkern 47 positive Elementarladungen.
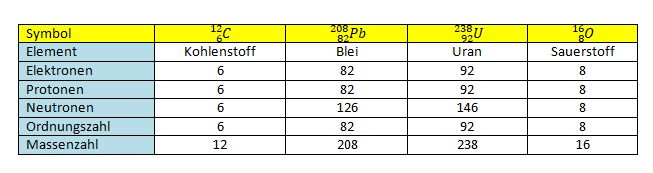
Aus der Chemie weiß man, dass es verschiedene Atome gibt. Diese sind im Periodensystem aufgeführt. Dort findet man neben den Namen der Atomarten auch viele Zahlen. Was bedeuten sie?
Auch gibt es bei einzelnen Atomarten auch noch verschiedene Exemplare, die Isotope. Worin unterscheiden sie sich?
Ein Heliumatom wird so bezeichnet: 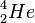 Ein Heliumatom hat 2 Protonen im Atomkern und 2 Elektronen in der Atomhülle. Z = 2 steht für die Anzahl der Ladungen sowohl der Protonen im Kern, als auch der Elektronen in der Hülle. Z = 2 wird auch als Kernladungszahl bezeichnet. Im Periodensystem ist 2 auch die Ordnungszahl von Helium. Im Atomkern sind auch noch 2 Neutronen, so dass insgesamt 2 Protonen und 2 Neutronen im Kern sind. Protonen und Neutronen werden als Kernbausteine oder Nukleonen bezeichnet. A = 4 ist dann die Nukleonenzahl.
Ein Heliumatom hat 2 Protonen im Atomkern und 2 Elektronen in der Atomhülle. Z = 2 steht für die Anzahl der Ladungen sowohl der Protonen im Kern, als auch der Elektronen in der Hülle. Z = 2 wird auch als Kernladungszahl bezeichnet. Im Periodensystem ist 2 auch die Ordnungszahl von Helium. Im Atomkern sind auch noch 2 Neutronen, so dass insgesamt 2 Protonen und 2 Neutronen im Kern sind. Protonen und Neutronen werden als Kernbausteine oder Nukleonen bezeichnet. A = 4 ist dann die Nukleonenzahl.
Aus der Schreibweise 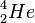 kann man nun ablesen, dass im Atomkern 4 Nukleonen sind, davon sind 2 Protonen. Natürlich sind dann auch 2 Elektronen in der Hülle. N = A - Z = 4 - 2 ist die Anzahl der Neutronen im Atomkern, die Neutronenzahl.
kann man nun ablesen, dass im Atomkern 4 Nukleonen sind, davon sind 2 Protonen. Natürlich sind dann auch 2 Elektronen in der Hülle. N = A - Z = 4 - 2 ist die Anzahl der Neutronen im Atomkern, die Neutronenzahl.
Fe ist die Bezeichnung der Atomart, es ist Eisen (lateinisch: ferrum)
Eisen hat im Atomkern A = 56 Nukleonen, davon sind Z = 26 Protonen. Damit weiß man, dass auch N = A - Z = 56 - 26 = 30 Neutronen im Atomkern sind.
|
Merke:
Atomkerne bestehen aus positiv geladenen Protonen und ungeladenen Neutronen. Protonen und Neutronen sind die Kernbausteine oder Nukleonen. Protonen und Neutronen haben ungefähr die gleiche Masse und gleichen Durchmesser. Bei der Schreibweise |
Es gibt auch verschiedene Atome der gleichen Atomart, seine Isotope.
Die Ordnungszahl Z = 1 sagt, dass es sich jeweils um Wasserstoff handelt. (H für hydrogenium). Jedes Wasserstoffatom hat Z = 1 Proton im Atomkern und 1 Elektron in der Atomhülle.
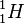 hat die Nukleonenzahl A = 1, also 1 Nukleon, in diesem Fall das Proton im Atomkern. Dann ist N = A - Z = 1 - 1 = 0 Neutronen im Atomkern..
hat die Nukleonenzahl A = 1, also 1 Nukleon, in diesem Fall das Proton im Atomkern. Dann ist N = A - Z = 1 - 1 = 0 Neutronen im Atomkern..
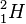 hat die Nukleonenzahl A = 2, also ist neben dem Proton noch ein Neutron im Atomkern. N = A - Z = 2 - 1 = 1 (Neutronenzahl).
hat die Nukleonenzahl A = 2, also ist neben dem Proton noch ein Neutron im Atomkern. N = A - Z = 2 - 1 = 1 (Neutronenzahl).
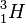 hat die Nukleonenzahl A = 3, also sind neben dem Proton noch zwei Neutronen im Atomkern. N = A - Z = 3 - 1 = 2 (Neutronenzahl).
hat die Nukleonenzahl A = 3, also sind neben dem Proton noch zwei Neutronen im Atomkern. N = A - Z = 3 - 1 = 2 (Neutronenzahl).|
Merke:
Die Atome eines Elements haben stets die gleiche Anzahl an Protonen (Protonenzahl = Ordnungszahl) und auch die gleichen chemischen Eigenschaften. Sie können sich in der Azahl der Neutronen im Atomkern unterscheiden. Es gibt verschiedene Isotope eines Atoms. (--> Nuklidkarte) |
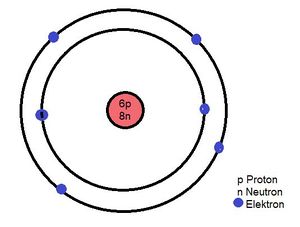
Kohlenstoff hat die Ordungszahl 6, also 6 Elektronen in der Atomhülle und 6 Protonen im Kern. Da die Massenzahl (Nukleonenzahl) A = 14 ist, sind 8 Neutronen im Atomkern.
Im Schalenmodell schaut das Atom so aus:
Ausblick: Experimente mit Protonen, Neutronen und Elektronen werden in großen Forschungsanlagen gemacht. In solchen Anlagen werden die Teilchen auf sehr große Geschwindigkeiten (Elektronen haben fast Lichtgeschwindigkeit) gebracht und sie treffen dann aufeinander.
Eine Anlage in USA ist SLAC und in Europa CERN
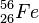 ?
?

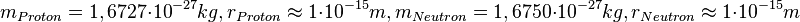
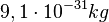 , bestimmen im Wesentlichen die Nukleonen die Atommasse. Daher ist die Massenzahl für ein Atom gleich der Nukleonenzahl A. Man verwendet auch A als Bezeichnung für die Massenzahl.
, bestimmen im Wesentlichen die Nukleonen die Atommasse. Daher ist die Massenzahl für ein Atom gleich der Nukleonenzahl A. Man verwendet auch A als Bezeichnung für die Massenzahl.
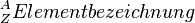 sind
sind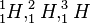 jeweils die richtigen Werte für N, Z, A.
jeweils die richtigen Werte für N, Z, A. 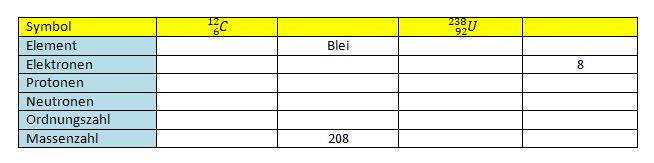
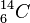 .
.

