Ph9 Atomare Abmessungen
Der Ölfleckversuch
Demokrit (ca. 459 v. Chr. bis 370 v. Chr.) war der Auffassung, dass Stoffe aus kleinsten, unteilbaren Einheiten bestehen würden. Diese Einheiten hat er als Atome bezeichnet (atomos kommt aus dem griechischen und heißt unteilbar).
Demokrit hatte sicher nicht die Vorstellung von Atomen wie wir sie heute kennen. Aber er nahm schon an, dass Atome verschiedenartige, feste und unteilbare Teilchen sind, die kombiniert die bekannten Substanzen bilden.
Erst Jahrtausende später hat Dalton postuliert, dass es kleinste, nicht weiter teilbare Teilchen gibt, die sich in ihrer Masse unterscheiden und in den vorhandenen Stoffen in jeweils ganz bestimmten Anzahlverhältnissen vorkommen. Chemische Reaktionen ordnen diese Atome nur um.
Nur was sind diese Atome und wie groß sind sie?
Die Abmessung eines Atoms kann man mit einem einfachen Versuch, dem Ölfleckversuch, abschätzen.
In diesem Video wird der Versuchsaufbau erklärt:
1. Bei einer monomolekularen Schicht verteilen sich alle Moleküle der Ölsäure in einer Schicht. Sie liegen nicht aufeinander, sondern alle nebeneinander.
2. Das Benzin verdunstet sofort und die Ölsäuremoleküle bleiben zurück.
Die Durchführung und Auswertung des Versuchs siehst du in diesem Video:
Die schematische Durchführung und Auswertung des Versuchs siehst du hier:
|
Merke:
Beim Ölfleckversuch lässt man einen Tropfen eines eines Ölsäure-Leichtbenzin-Gemisches mit bekanntem Volumen V auf eine ebene Wasseroberfläche auftropfen, die vorher mit Lykopodium (Bärlappsporen) bestreut war. Der Tropfen der Mischung breitet sich kreisförmig aus.Beim Auftreffen des Tropfens auf der Wasseroberfläche verdampft sofort das Leichtbenzin. Das Lykopodium wird verdrängt und umgibt den Tropfen, der einen Kreis auf der Oberfläche des Wasser bildet. Daher kann man den Durchmesser d des Kreises abmessen und den Flächeninhalt A bestimmen. |
1. V = 0,018cm3
2. 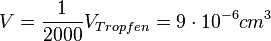
3. 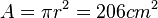 ,
, 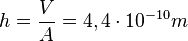
4. 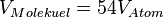 ,
, 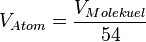
![h^3 = 54d_{Atom}^3 \rightarrow d_{Atom}=\frac{h}{\sqrt[3]{54}}=1,2\cdot 10^{-10}m](/images/math/5/d/e/5de397fa61b51036e8d99d4ebbc2aa74.png)
|
Merke:
Der Durchmesser eines Atoms ist von der Größenordnung |
Streuversuch von Rutherford
Man weiß nun, dass der Atomdurchmesser ungefähr 0,000 000 000 1m ist. Doch wie schaut es im Atom weiter aus?
Vor dem Rutherfordschen Atommodell war das Rosinenkuchenmodell von Thomson. Thomson stellte sich vor, dass ein Atom aus positiver Masse besteht, die eine genauso Ladung hat wie die Anzahl der Elektronen, welche wie Rosinen im Kuchen in der Atommasse verteilt sind.
Rutherford untersuchte in Streuexperimenten, wie 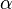 -Teilchen an einer Goldfolie gestreut wurden.
-Teilchen an einer Goldfolie gestreut wurden.
In diesem Video
wird der Streuversuch von Rutherford erklärt und im nächsten Video erfährst du mehr über sein Atommodell
|
Merke:
Ein Atom besteht aus einem Atomkern und der Atomhülle. |
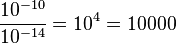 . Das Atom ist also 10000 mal größer als der Atomkern.
. Das Atom ist also 10000 mal größer als der Atomkern.Zum Abschluss noch ein Video, den man gesehen haben muss. Hier geht es um Dimensionen in Zehnerpotenzen vom "Alltag" bis "ganz groß" und bis "ganz klein".
Atommodelle
Ein wichtiges und oftmals ausreichendes Atommodell hat Bohr entwickelt.
|
Merke:
Im Bohrschen Atommodell ist die Masse des Atom im positiv geladenen Atomkern konzentriert. In der Hülle umlaufen die Elektronen auf festen Bahnen, die durch Quantenbedingungen bestimmt sind, den Atomkern. |

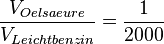 . Berechne das Volumen der Ölsäure im Tropfen.
. Berechne das Volumen der Ölsäure im Tropfen.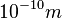
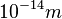 .
.

